Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.

По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Лабораторная посуда и оборудование
| Оборудование | Название оборудования | Назначение |
| Делительная воронка | Для разделения несмешивающихся жидкостей | |
| Бюретка | Для отбора точных объёмов жидкостей | |
| Пипетка Мора | Для отбора точных объёмов жидкостей | |
| Мерный цилиндр | Для отбора точных объёмов жидкостей | |
| Воронка химическая | Для фильтрования растворов | |
| Колба двугорлая | Для проведения химических синтезов | |
| Колба трехгорлая | Для проведения химических синтезов | |
| Колба Бунзена | Для проведения перекристаллизации | |
| Бюкс | Для хранения веществ | |
| Пробирка | Для проведения химических опытов | |
| Химический стакан | Для приготовления и отбора порции растворов | |
| Мерная колба | Для приготовления растворов с заданной концентрацией | |
| Колба коническая | Для проведения химических опытов | |
| Колба круглодонная | Для проведения химических опытов | |
 |
Штатив | Для проведения химических опытов |
 |
Шпатель химический | Отбор твердых веществ |
Хранение реактивов
В лабораторном помещении должны храниться лишь небольшие запасы химических веществ. Их держат в банках, склянках с пришлифованными стеклянными пробками или пластмассовыми крышками с герметизирующими прокладками из полиэтилена.
На каждом сосуде должна быть этикетка с обозначением, что в нем находится. Для лучшей сохранности бумажные этикетки рекомендуется заклеивать прозрачной полиэтиленовой клейкой лентой. Временные надписи могут быть сделаны карандашом для стекла: место, на которое намечается надпись, следует слегка нагреть.
Строго запрещается хранить вещества в сосудах без этикеток или надписей! Если этикетки нет, применять реактив нельзя. Если не удается установить состав реактива, его следует уничтожить.
Небольшие количества веществ, выделяющих ядовитые или раздражающие дыхательные пути пары (бром, олеум, фтористоводородная и концентрированная соляная кислоты, аммиак, тионилхлорид, сульфурилхлорид и др.), равно как и концентрированных серной, азотной, уксусной кислот допустимо хранить в вытяжном шкафу на специально отведенных для них полках.
Запасы подобных веществ следует хранить в вытяжных шкафах вентилируемых хранилищ, доступ в которые должен быть ограничен.
Общий запас одновременно хранящихся в каждом рабочем помещении лаборатории огнеопасных и легковоспламеняющихся жидкостей не должен превышать суточной потребности, но не более 2-3 л на одного сотрудника. Склянки, в которых содержится более 50 мл ЛВЖ, должны храниться в железных ящиках для горючего с плотно закрывающейся крышкой, со стенками и дном, выложенными асбестом. Ящик устанавливают на полу вдали от нагревательных приборов; к нему должен быть удобный подход. Запрещается хранить горючие жидкости в полиэтиленовой и в тонкостенной посуде вместимостью более 200 мл. Недопустимо хранить горючие жидкости в вытяжном шкафу, где производят работы с нагревательными приборами или рядом с окислителями (Сl2, Н2O2, Br2, KMnO4 и др.).
Щелочные металлы следует хранить под слоем обезвоженного трансформаторного масла или керосина в стеклянной банке, плотно закрытой корковой пробкой. Слой масла (керосина) над металлом должен быть не менее 15-20 мм.
Количество металлического натрия или калия, хранящихся в лабораторном помещении, не должно превышать однодневной потребности. При длительном хранении на поверхности металлического калия образуются перекиси, которые при непосредственном контакте с металлическим калием (например, при разрезании ножом на воздухе) дают сильные взрывы.
Перекисные соединения следует хранить, как огне- и взрывоопасные вещества. Температура их хранения должна быть значительно ниже температуры их разложения. Нестабильные перекиси хранят при пониженной температуре. Органические перекиси и гидроперекиси хранят только в емкостях из стекла или полиэтилена высокого давления.
Реактивы, изменяющиеся под действием света, хранят в желтых или темных склянках и банках.
Ядовитые вещества (соли ртути (II), алкалоиды, некоторые эфиры фосфорной кислоты, цианиды) следует хранить в вентилируемых закрытых и опечатанных шкафах и сейфах.
Металлическую ртуть в относительно малых количествах хранят в толстостенной герметически закрытой стеклянной посуде в вытяжном шкафу. Надежно и удобно хранение ртути в запаянных стеклянных толстостенных ампулах по 30-40 мл. Ампулы рекомендуется укладывать в тонкостенные стальные коробки. В таком виде ртуть можно держать в лабораторных шкафах вместе с другими реактивами.
При хранении запасов реактивов в первую очередь следует организовать раздельное хранение веществ, несовместимых по свойствам. Например, хлорат калия, перманганат калия, перекись водорода и другие окислители нельзя хранить рядом с восстановителями — серой, крахмалом, углем и др.
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.

Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
Литий добавляется во многие сплавы для улучшения металлических свойств.
Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
Франций пока не имеет практического применения в связи с высокой радиоактивностью.
Рекомендации по правильному хранению
По причине своей агрессивности щелочные металлы хранят под 15-ти миллиметровым слоем керосина, вазелина или трансформаторного масла в герметичных емкостях. Хранение химически активных веществ возможно в специальной кладовой, без доступа влаги и огня. Стеклянные или фарфоровые емкости закрывают пробками, снабженными У-образными хлоркальцевыми трубками для защиты от влаги и этикетками с четкой записью наименования вещества.
Помещать в емкость и вынимать металлы из тары следует только с помощью сухого пинцета или специальными щипцами
Поверхность кусков промокнуть бумажным фильтром.
Для хранения агрессивных химических реактивов необходимы специальные лабораторные шкафы с вытяжной системой.
Небольшие количества реактивов производители расфасовывают в запаянные капсулы, удобные даже для длительного хранения.
Категорически запрещается смешивать остатки и обрезки разных металлов, доводить их количество больше 2 грамм.
При утилизации остатков металлов после опытов также требуется соблюдать осторожность. Их обязательно необходимо нейтрализовать, очень медленно добавляя спирт или эфир, залить большим количеством воды, только после этого сливать в канализацию.
Тару после щелочных металлов обрабатывают спиртом, затем тщательно моют проточной водой.
Все работающие с химически активными веществами обязаны пользоваться защитными очками или масками, перчатками, резиновыми сапогами, прорезиненным фартуком, противогазом или респиратором.
Поскольку щелочные металлы и многие их соединения являются пожаро- взрывоопасными, домой их лучше не приносить, а хранить в специальном помещении или лаборатории, соблюдая технику безопасности.
Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов

Как видно из таблицы, чем выше активность элемента, тем ниже его встречаемость в природе. Элемент последнего периода первой группы – франций – вообще не встречается в природе даже в составе минералов. Этот элемент является радиоактивным и является промежуточным продуктом распада Урана-235. Его общее содержание в земной коре оценивается в 380 граммов.
Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.

Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Хранение — щелочной металл
Хранение щелочных металлов ( натрия, калия, лития) должно отвечать приведенным ниже требованиям.
Хранение щелочных металлов и работа с ними требует строгого соблюдения правил техники безопасности. При хранении необходимо преградить доступ воздуха и влаги к металлам во избежание взрывов и пожаров.
Хранение щелочных металлов и работа с ними требует строгого соблюдения правил техники безопасности. При хранении необходимо преградить доступ воздуха п влаги к металлам во избежание взрывов и пожаров.
Хранение щелочных металлов и работа с ними требует строгого соблюдения правил техники безопасности. При хранении необходимо преградить доступ воздуха и влаги к металлам во избежание взрывов и пожаров.
Хранение щелочных металлов и работа с ними тре — буют строгого соблюдения правил техники безопасно сти. При хранении необходимо преградить доступ воздуха и влаги к металлам во избежание взрывов и пожаров.
Хранение щелочных металлов и работа с ними тре — буют строгого соблюдения правил техники безопасно сти. При хранении необходимо преградить доступ воз духа и влаги к металлам во избежание взрывов и пожаров.
Какие существуют правила хранения щелочных металлов, огнеопасных веществ ( приведите примеры), ядовитых и сильнодействующих веществ.
Необходимость в специальных складах для хранения щелочных металлов возникает при их расходе свыше 1 5 т в год. Статистически обоснованные нормы потерь в процессе эксплуатации еще не составлены. Повышенный расход теплоносителя возникает при аварийных изливах, при ремонте оборудования, сопровождающемся его демонтажем и промывкой. Аварии, а часто и ремонтные работы непрогнозируемы и носят случайный характер. Потери теплоносителя, связанные с ремонтом, могут варьироваться в широких пределах: от полного объема, содержащегося в полостях аппарата, до количества, остающегося лишь на смоченных поверхностях, из расчета, что толщина жидкой пленки не превышает 0 1 мм.
|
Принципиальная схема универсального стенда. |
В помещении склада хранятся щелочные металлы, поступившие с заводов-изготовителей, а также металлы, полученные в результате регенерации. Склад оборудован двухъярусными стеллажами для хранения щелочного металла как в стандартной, так и в нестандартной расфасовке.
Хранить щелочные и щелочноземельные металлы следует в особых условиях. Допускается хранение лития под слоем обезвоженного бензола или бензина ( плотность 0 56 г / мл) в заполненных доверху и плотно закрытых стеклянных сосудах с пришлифованной стеклянной пробкой. При хранении щелочных металлов в обезвоженном керосине наблюдается окисление их поверхности.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
Элементы группы наделены общими физическими свойствами:
- Мягкость. Любой (кроме лития) легко режется.
- Легкость. Плотность лития, натрия, калия меньше единицы. Они не тонут в воде.
- Серебристо-белый цвет. Только цезий наделен желтоватостью на серебристом фоне.
- Металлический отблеск.
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
- Разогретые щелочные элементы реагируют с азотом, кремнием, галогенами, серой, фосфором, углеродом. Результат – соответствующие продукты (галогениды, сульфиды, карбиды, силициды, др.)
- При нагревании с прочими металлами образуются полуметаллы (интерметаллиды).
- На воздухе сгорают.
Окраска пламени щелочными металлами и их соединениями:
| Щелочной металл | Цвет пламени |
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
- Калий создает пламя фиалковой гаммы, взрыв самый сильный.
- У натрия пламя желтое, взрыв послабее.
- Литий просто горит.
Взрывом заканчивается реакция с кислотами.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Формула кислородного соединения | Цвет |
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Последние заданные вопросы в категории Химия
Химия 06.08.2023 14:01 0 Вовна Алексей.
Реакция метана с бромной водой
Ответов: 1
Химия 06.08.2023 14:01 0 Тухсанов Марат.
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения: H2SiO3 S
Ответов: 1
Химия 06.08.2023 14:02 0 Кочетов Валентин.
какие жиры труднее перевариваются в организме почему кратко как ответ на вопрос, а не как доклад там
Ответов: 2
Химия 06.08.2023 14:01 0 Кузьма Анастасія.
Как из MnSO4 получить Mn???
Ответов: 1
Химия 06.08.2023 14:01 0 Скрябина Елизавета.
Проставить степени окисления всех атомов в ОВР, определить переход электронов, расставить коэффициен
Ответов: 2
Химия 06.08.2023 14:03 0 Субботин Владислав.
Допоможіть!! Напишіть будь ласка формулу азота
Ответов: 1
Химия 06.08.2023 14:02 0 Денисова Януська.
Помогите по химии : 1) Вычислите массу и количества вещества гидроксида алюминия полученного при р
Ответов: 2
Химия 06.08.2023 14:23 0 Ситникова Виктория.
Вычислите массовую долю Na(OH) в растворе полученном при смешивании 200гр 5% раствора и 300гр 20% ра
Ответов: 1
Химия 06.08.2023 14:01 0 Приколист Магомед.
Решите пожалуйста что-нибудь из этого
Ответов: 1
Химия 06.08.2023 14:01 0 Невмержицький Богдан.
Какие в-ва получаются в результате реакции фенола и метилата натрия?
Ответов: 1
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
К ядовитым веществам относятся:
1. Вещества, раздражающие слизистые оболочки и действующие на кожные покровы: щелочи, кислота, газообразный аммиак, оксиды азота, оксиды серы (VI) и (IV).
2. Вещества, которые воздействуют на нервную систему, например, аммиак, сероводород, бензол и др.
3. Вещества, поражающие кровь и органы: оксид углерода (II), соединения свинца и др.
К горючим веществам относятся бензин, ацетон, метиловый и этиловый спирты, толуол и др.
К едким веществам относятся концентрированные кислоты и щелочи, концентрированные растворы некоторых солей и др.
При работе с горючими, едкими и токсичными веществами необходимо соблюдать следующие правила безопасности:
1. Категорически запрещается сливать в раковину легковоспламеняющиеся и горючие жидкости, концентрированные растворы кислот и щелочей. Их необходимо собирать в специальные герметические сосуды.
2. Работу с кислотами, твердыми щелочами, едкими и токсичными веществами проводить только в защитных очках и перчатках. При растворении твердых щелочей в воде необходимо добавлять щелочь небольшими порциями в воду, избегая перегревания раствора. Разбавление кислот или щелочей необходимо производить в жаростойкой посуде.
3. Кислота в воду или вода в кислоту? При разбавлении концентрированных кислот и щелочей необходимо небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот. Растворение кислот и щелочей в воде сопровождается выделением большого количества теплоты. Небольшая порция воды может нагреться при добавлении в кислоту, смесь закипит и может попасть на лицо или руки. Поэтому необходимо добавлять небольшое количество кислоты в большое количество воды.
4. При разливе легковоспламеняющейся или горючей жидкости необходимо отключить все электроприборы и погасить газовые горелки. Место разлива засыпают песком, который затем удаляют с помощью лопатки. Запрещено использовать металлические совки, т.к. они могут дать искру и вызвать пожар.
5. Кислоту, пролитую на пол, нейтрализуют содой, а щелочь нейтрализуют борной кислотой. Для удаления нейтрализованных жидкостей также используют песок. Нейтрализацию и уборку концентрированных кислот необходимо проводить в противогазе.
6. При ожоге кислотой необходимо немедленно промыть пораженное место большим количеством воды. После чего промыть место поражения двухпроцентным раствором соды.
7. При ожоге щелочью необходимо длительное промывание пораженного места под струей воды, затем однопроцентным раствором борной кислоты или уксусной кислоты.
8. При ожоге глаз кислотой или щелочью необходимо немедленно промыть глаза водой длительное время.
9. Работы с токсичными, легковоспламеняющимися или горючими веществами необходимо проводить строго под включенной вытяжкой.
10. Легковоспламеняющиеся и горючие жидкости запрещено нагревать на открытом пламени.
11. Запрещено сливать горючие, едкие и токсичные вещества в канализацию. Для их утилизации и слива используют специальные емкости.
12. Работа с плавиковой кислотой требует особой осторожности и проводится обязательно в вытяжном шкафу. Хранить плавиковую кислоту необходимо в полиэтиленовой таре (угадайте, почему)
13. Щелочные и щелочноземельные металлы необходимо хранить в сосуде, не пропускающем ультрафиолет, под слоем керосина или другого инертного по отношению к этим металлам вещества
При работе с этими металлами необходимо соблюдать осторожность, избегать контакта этих металлов с водой. Запрещается трогать щелочные или щелочноземельные металлы руками
Небольшие остатки таких металлов запрещается выкидывать в канализацию или мусорное ведро. Их необходимо «погасить» этанолом или другим веществом (но не водой!).
При работе со средствами бытовой химии также необходимо соблюдать определенные правила:
1. В обязательном порядке пользуйтесь перчатками при работе с агрессивными средствами бытовой химии. Если вы работаете с хлорсодержащими препаратами, рекомендуется надеть специальные защитные очки из пластика.
2. Не забывайте тщательно удалять остатки чистящих или моющих средств после каждой уборки. Многие порошки состоят из мелких частиц, которые оставаться на поверхностях и вещах. При испарении такие химикаты выделяют ряд вредных веществ.
3. Хранить средства бытовой химии следует в герметично закрытых ёмкостях вдали от источников тепла и прямого солнечного света.
4. Все средства бытовой химии следует применять только по прямому назначению, строго соблюдая инструкции и рекомендации по их использованию.
Подземные хранилища для щелочных металлов: безопасность и надежность
Щелочные металлы, такие как цезий, рубидий и калий, являются важными химическими элементами, которые широко используются в различных отраслях промышленности, медицине и научных исследованиях. Однако их хранение может быть сложной задачей из-за их высокой реактивности и потенциальной опасности. Подземные хранилища представляют собой один из наиболее безопасных и надежных способов сохранения этих металлов.
Одной из основных преимуществ подземных хранилищ является их способность обеспечить стабильные условия хранения. Они защищены от колебаний температуры, воздействия влаги и других факторов окружающей среды
Это важно для сохранения цезия, рубидия и калия, так как они могут реагировать с кислородом и воздухом, а также могут взрываться при взаимодействии с водой
Другим преимуществом подземных хранилищ является их высокий уровень безопасности. Они обеспечивают защиту от утечек и проникновения внешних веществ, а также предотвращают случайные взрывы или пожары. Многие подземные хранилища имеют дополнительные системы безопасности, такие как контроль доступа и системы пожаротушения.
Подземные хранилища для щелочных металлов также предлагают ряд преимуществ с точки зрения эффективности использования пространства. Они могут быть компактными и иметь большую плотность хранения, что позволяет экономить пространство на поверхности земли и использовать его для других целей.
Наконец, подземные хранилища обладают высокой надежностью и долговечностью. Они строются из прочных материалов и проходят строгую проверку соответствия нормам и требованиям безопасности. Такие хранилища позволяют длительное время сохранять щелочные металлы в идеальных условиях, минимизируя риск их потери или повреждения.
Где используются
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
- Каустическая сода (в просторечии едкий натр) – ингредиент при варке мыла, производстве алюминия, искусственных волокон.
- Кальцинированная сода – сырье для получения мыла, стекла, заменитель хозяйственного мыла.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
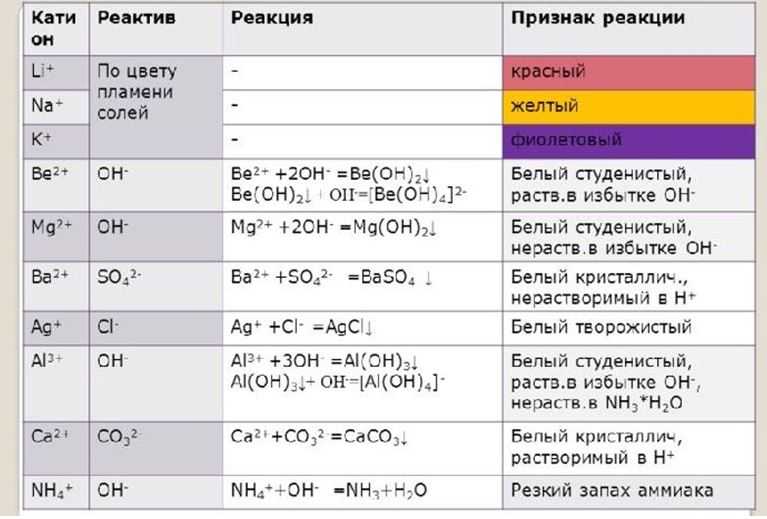
Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
3Li+ + PO43- = Li 3РО 4↓
В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
Li+ + F- = LiF↓
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Na+ + [Sb (OH)6]– = Na[Sb(OH)6] ↓
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] ↓+ 2Na+
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
K+ + NaHC4H406= KHC4H4O6↓ + Na+.
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Кислородные соединения натрия. Едкий натр
Кислородными соединениями натрия, как уже было сказано, являются окись натрия Na2O и перекись натрия Na2O2. Окись натрия Na2O особого значения не имеет. Она энергично реагирует с водой, образуя едкий натр: Na2O + Н2O = 2NaOH Перекись натрия Na202 — желтоватый порошок. Ее можно рассматривать как своеобразную соль перекиси водорода, ибо структура ее такая же, как у Н2O2. Как и перекись водорода, перекись натрия является сильнейшим окислителем. При действии воды она образует щелочь и перекись водорода: Na2O2 + Н2O = Н2O2 + 2NaOH Перекись водорода образуется и при действии разбавленных кислот на перекись натрия: Na2O2 + H2SO4 = Н2O2 + Na2SO4 Все указанные выше свойства перекиси натрия позволяют использовать ее для отбелки все возможных материалов.
Рис. 77. Схема установки для электролиза раствора поваренной соли. 1 — анод; 2 — диафрагма, разделяющее анодное и катодное пространство; 3 —катод
Очень важным соединением натрия является гидроокись натрия, или едкий натр, NaOH. Его называют также каустической содой, или просто каустиком. Для получения едкого натра используют поваренную соль — наиболее дешевое природное соединение натрия, подвергая ее электролизу, но в этом случае применяют не расплав, а раствор соли (рис. 77). Описание процесса электролиза раствора поваренной соли см. § 33. На рис. 77 показано, что анодное и катодное пространство разделено диафрагмой. Это сделано с той целью, чтобы образующиеся продукты не вступали между собой во взаимодействие, например Сl2 + 2NaOH = NaClO + NaCl + Н2O.
Едкий натр — твердое кристаллическое вещество белого цвета, прекрасно растворимое в воде. При растворении едкого натра в воде выделяется большое количество тепла и раствор сильно разогревается. Едкий натр необходимо хранить в хорошо закупоренных сосудах, чтобы предохранить его от проникновения водяных паров, под действием которых он может сильно увлажниться, а также двуокиси углерода, под действием которой едкий натр может постепенно превратиться в карбонат натрия: 2NaOH + СO2 = Na2CO3+ Н2O
Едкий натр—типичная щелочь, поэтому меры предосторожности при работе с ним такие же, как и при работе с любыми другими щелочами. Едкий натр применяется во многих отраслях промышленности, например для очистки нефтепродуктов, производства мыла из жиров, в бумажной промышленности, в производстве искусственного волокна и красителей, производстве медикаментов и др
(рис. 78).
• Запишите в тетрадь области применения едкого натра.
Из солей натрия следует отметить в первую очередь поваренную соль NaCl, которая служит основным сырьем для получения едкого натра и металлического натрия (подробно об этой соли см. стр. 164), соду Na2CO3 (см. стр. 278), сульфат натрия Na2SO4 (см. стр. 224), нитрат натрия NaNO3 (см. стр. 250) и др.
Рис. 78. Применение едкого натра
■ 32. Опишите способ получения едкого натра электролизом поваренной соли. (См. Ответ) 33. Едкий натр можно получить действием на карбонат натрия гашеной известью. Составьте молекулярную и ионные формы уравнения этой реакции, а также рассчитайте, сколько соды, содержащей 95% карбоната, потребуется для получения 40 кг едкого натра. 34. Почему при хранении раствора едкого натра в склянках с притертыми пробками пробки «заедают» и их нельзя вынуть? Если же в течение некоторого срока подержать склянку опрокинутой в воду, то пробка свободно вынимается. Объясните, приведя уравнения реакций, что за процессы имеют место в данном случае. 35. Напишите уравнения реакций в молекулярной и ионных формах, характеризующих свойства едкого натра как типичной щелочи. 36
Какие меры предосторожности следует соблюдать при работе с едким натром? Какие меры первой помощи следует оказать при ожогах едким натром? (См. Ответ)
Квалификация реактивов и высокочистых веществ
В зависимости от содержания основного вещества и допустимых примесей для химических реактивов установлены следующие квалификации.
Чистый (ч.) — низшая квалификация реактива. Содержание основного вещества не менее 98%; содержание примесей или нелетучего остатка 0,01-0,5%; остаток после прокаливания — до 0,5%.
Чистый для анализа (ч. д. а.). Эта квалификация характеризует аналитическое применение препарата. Содержание основного вещества не менее 99%.
Химически чистый (х. ч.). Высшая степень чистоты препарата. Содержание отдельных примесей в пределах 0,001-0,00001% и нелетучего остатка не более 0,1%; остаток после прокаливания не более 0,1%.
Высокочистые вещества, подразделяемые на спектрально-чистые (сп. ч.), эталонной чистоты (в. э. ч.) и особо чистые (ос. ч.).
Содержание основного вещества и предельное содержание нежелательных примесей в эталонно-чистых веществах должно соответствовать марке эталона (в зависимости от его назначения).
Перед символом в. э. ч. стоит цифра, обозначающая общее процентное содержание лимитируемых примесей, а после символа — две цифры, разделенные тире; первая означает число лимитируемых примесей, а вторая — максимальное содержание этих примесей (в процентах), выраженное как абсолютное значение показателя степени порядкового множителя. Например, марка вещества эталонной чистоты, содержащего 99,998% основного вещества, в котором лимитируется три примеси, причем их общее содержание не должно превышать 0,00001%, обозначается «002 в. э. ч. 3-5».
Содержание примесей в особо чистых веществах лимитируется в пределах 10 в минус 5 – 10 в минус 10%.
Если в веществе особой чистоты лимитируются лишь неорганические примеси, то за символом ос. ч. следуют две цифры, из которых первая указывает число лимитируемых примесей, а вторая — их суммарное содержание (в процентах), выраженное как абсолютное значение показателя степени порядкового множителя. Например, марка «кремний ос. ч. 21-5» означает, что в кремнии лимитировано содержание 21 неорганической примеси, суммарное содержание которых не превышает 0,00001%.
Если для особо чистых веществ лимитируются только органические примеси, перед символом ос. ч. ставятся буквы «оп» с цифрой, обозначающей их предельное содержание. Например, марка особо чистого вещества с суммарным содержанием органических примесей 0,001% обозначается «оп-3 ос. ч.».
Марка особо чистых веществ, для которых лимитируются как неорганические, так и органические примеси, обозначается с учетом содержания этих примесей. Например, марка вещества, для которого сумма органических примесей лимитируется величиной 0,0001%, а сумма восьми неорганических примесей составляет 0,00001%, обозначается «оп-4 ос. ч. 8-5».
Высокочистые вещества используются в новых отраслях техники, и в зависимости от области применения к ним предъявляются особые технические требования.
Химические реактивы классифицируют часто по областям их преимущественного применения: индикаторы, красители для микроскопии, для хроматографии (сорбенты, носители, неподвижные фазы н др.), для люминофоров, для фотографии, для криоскопии, для спектрального анализа и т. д.
Во многих случаях после названия реактива указывается область применения реактива, а затем степень его чистоты. Например: бензол для криоскопии х. ч., судан Ж краситель для микроскопии ч. д. а., кальция окись для хроматографии ч. д. а. и т. д.
Единой международной квалификации химических реактивов и высокочистых веществ не существует. Реактивы, поставляемые странами-членами СЭВ, квалифицируются так, как принято в СССР.
Согласно ГОСТ 3885-73, реактивы (препараты) должны быть упакованы в соответствующую потребительскую тару, герметически упакованы и снабжены стандартной этикеткой.
Для реактива каждой квалификации этикетка на таре должна быть определенного цвета или на этикетке должна быть цветная полоса:

При наличии у реактивов ядовитых, огнеопасных и взрывоопасных свойств наклеивается отдельная этикетка с надписями «Огнеопасно» — красная; «Яд» — желтая; «Взрывоопасно» — голубая; «Беречь от воды» — зеленая.
Учимся правильно хранить щелочь
Так бывает, что сварил мыло, а оно плохо мылится, не застыло или вообще, еще на этапе смешивания щелочи с маслами, полетело в мусорный бак. И вроде бы рецепт хороший, все правильно рассчитано, а мыло все-равно не получилось. Причин может быть много, но самая распространенная — плохая щелочь. Тем, кто уже мыловарит во всю или только начинает, приходится хранить щелочь, и от этого никуда не денешься, не выкидывать же остатки?! Но так как она требует соблюдения техники безопасности и некоторых правил не только при ее использовании, но и при хранении, этот вопрос следует разобрать подробно.
Во-первых, щелочь стоит хранить в пластиковой таре, так как она может разъедать стекло или фарфор.
Во-вторых, тара должна герметично закрываться, так как щелочь гигроскопична, то есть она впитывает влагу из воздуха, тем самым, теряя свои свойства. Лучше всего для этих целей подойдет пакет, а лучше два или пластиковая бутылка. Обязательно подпишите их, чтобы кто-нибудь случайно не открыл.
Чтобы щелочь лучше хранилась, ее необходимо расфасовать небольшими партиями. При этом соблюдение техники безопасности (очки, перчатки, респиратор) обязательно.
Естественно, тару со щелочью нужно убрать подальше и повыше.
Есть еще один вариант — щелочь можно хранить в виде раствора. Для этого необходимо найти пластиковую бутылку с толстыми стенками (то есть бутылка из-под нарзана или масла не подойдет), и проверить, чтобы крышка плотно закрывалась. Чтобы не забыть, указываем на бутылке какой именно это раствор (натриевый или калиевый), соотношение воды и щелочи и предупредительную информацию для любопытных.
Минимальное количество воды, которая может растворить щелочь, составляет соотношение 1:1. Поэтому, необходимо отмерить равное количество воды и щелочи. Не забываем про технику безопасности! Смешать их в жаростойкой посуде. Помним: засыпаем щелочь в воду, не наоборот. И, когда раствор немного остынет, перелить его в бутылку и убрать до использования. Пользоваться раствором очень удобно, и не надо каждый раз готовить новый. Так, например, составляем рецепт, где щелочи надо 58,3 гр и воды 105 гр Помним, что концентрация раствора 1:1, поэтому умножаем количество щелочи на 2, отмеряем 116,6 гр раствора, при необходимости можно добавить воду 105 — 58,3 = 46,7 гр.
А еще щелочь можно использовать не только при изготовлении мыла! В быту щелочь прекрасно устраняет засоры. Для этого необходимо залить раствор щелочи в засорившуюся трубу или в воду засыпать немного гранул. Через час смыть холодной водой остатки раствора.
Спасибо за внимание!





























